编辑推荐:
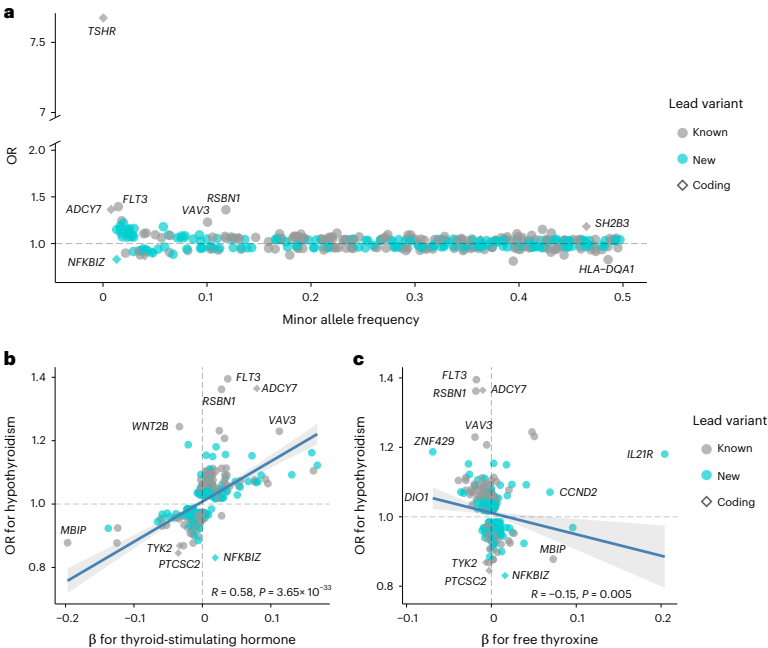
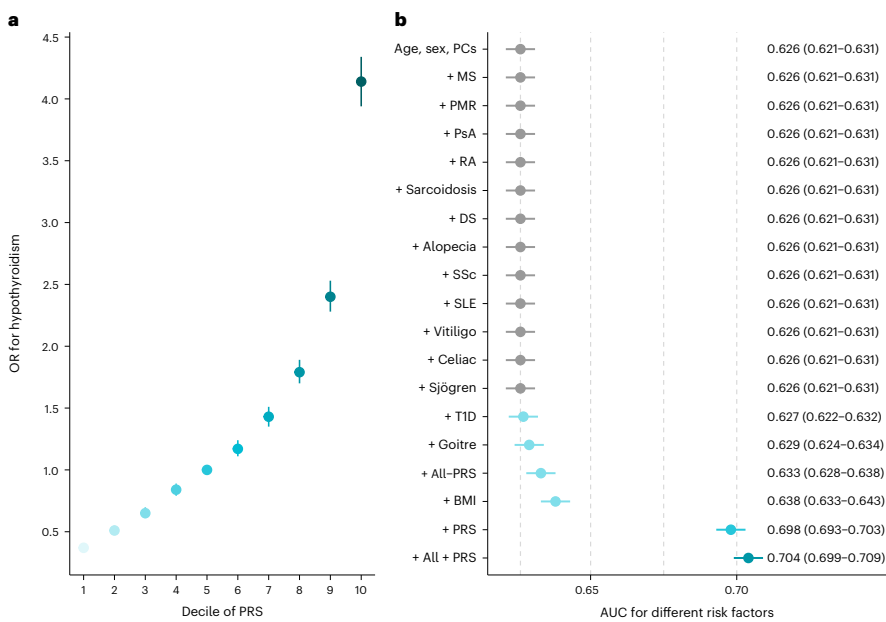
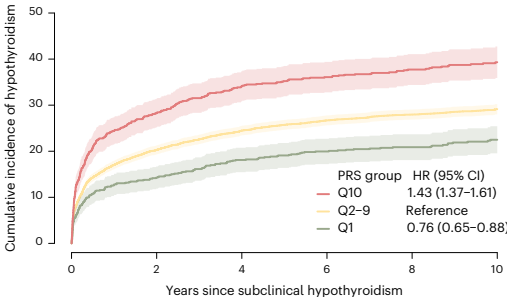
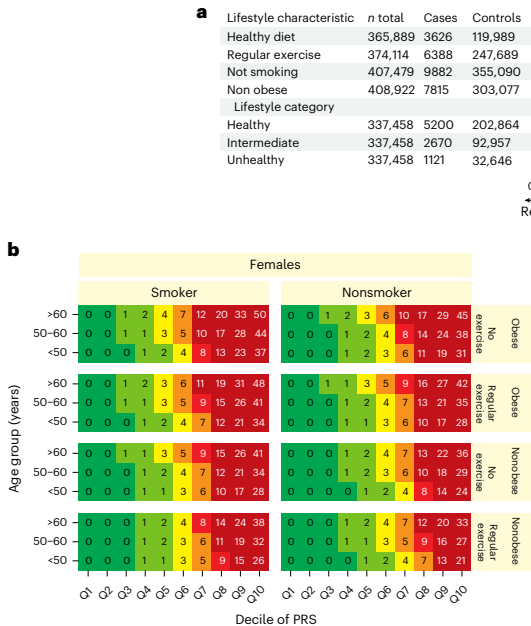
本研究针对甲状腺功能减退症诊断延迟和亚临床甲状腺功能减退症(SCH)进展预测困难等临床挑战,通过开展大规模全基因组关联研究(GWAS)荟萃分析,纳入113,393例病例和1,065,268例对照,鉴定出350个风险位点,其中179个为新发现。研究人员开发了包含110万+变异的PRS,发现结合PRS与甲状腺激素、甲状腺过氧化物酶抗体(anti-TPO)可显著提升预测准确性,PRS还能有效分层SCH患者的疾病进展风险,为甲状腺激素缺乏症的精准预测提供了新工具。
 生物通微信公众号
生物通微信公众号
生物通 版权所有